Pilas de Combustible: La Energía del Futuro
A principios del siglo XX las casas alumbraban sus noches quemando combustibles: gas de alumbrado en zonas urbanas privilegiadas, candiles o quinqués de aceite o queroseno en el resto a pesar de que en 1879 Thomas A. Edison había patentado la bombilla eléctrica. Pero veinte o treinta años después esos inventos modernos seguían siendo curiosidades al alcance de muy pocos. Cuando las lámparas eléctricas incandescentes sustituyeron a las lámparas de combustible y desterraron su tufillo y su hollín, las casas se volvieron más brillantes, más limpias y más seguras.
A principios del siglo XXI esta pugna entre tecnologías de combustión y tecnologías limpias se ha trasladado a la calle. Noventa años de automóviles de combustión nos ha llevado a una fuerte dependencia del transporte rápido individual, pero a costa de contaminar nuestro aire. Una posible alternativa se encuentra en las llamadas pilas de combustible.
Un poco de química
Las celdas de combustible se basan en reactores electroquímicos donde la energía química se convierte en electricidad, sin mediar proceso alguno de "combustión". El dispositivo es muy simple: está formada por dos electrodos separados por un electrolito (un material especialmente tratado que permite el paso de iones -átomos cargados positiva o negativamente- pero no de electrones). En el electrodo negativo (ánodo) tiene lugar la oxidación del combustible (normalmente hidrógeno aunque puede ser metanol u otros) y en el positivo (cátodo), la reducción del oxígeno del aire.
Así, una de las reacciones más simples que se pueden dar en una celda es que el oxígeno y el hidrógeno se combinen para formar agua y producir energía eléctrica y calor.
Reacción en el ánodo 2H2 ---------- 4H+ + 4e-
Reacción en el cátodo O2 + 4H+ + 4e- --------- 2 H2O
La celda consiste en un ánodo en el que se inyecta el combustible -hidrógeno, amoníaco o hidracina- y un cátodo en el que se introduce un oxidante -aire u oxígeno-. Los dos electrodos de una pila de combustible están separados por un electrolito iónico conductor.
El hidrógeno penetra por el ánodo y en presencia de un catalizador se disocia en los iones positivos y electrones. El oxígeno del aire penetra por el cátodo y se disocia en iones negativos, también en presencia del catalizador. Los iones de hidrógeno migran a través del electrolito mientras que los electrones circulan a través del circuito externo (como puede ser el motor eléctrico del coche). De esta forma en el cátodo vuelven a recombinarse y se produce agua y una cantidad importante de energía térmica.
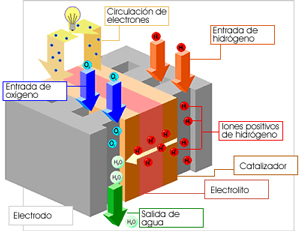
Una pila de combustible
Una sola de estas celdas genera alrededor de un voltio en circuito abierto; si se necesita un voltaje mayor y alta potencia se conectan en serie el número necesario para formar un apilamiento que se llama pila de combustible.
En esta pila hay que añadir sistemas que permitan disipar el calor, que los gases puedan circular con facilidad y que haya terminales eléctricos para poder utilizar la energía eléctrica que se produzca.
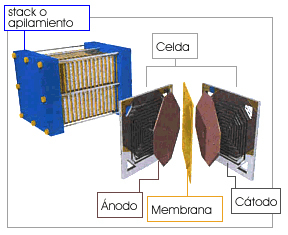
Tipos de pilas de combustible

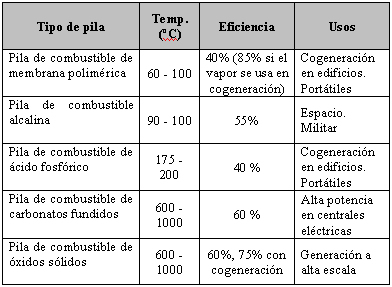
Generalmente las pilas de combustible se clasifican en función del tipo de electrolito que utilizan. Las principales diferencias entre ellas son las temperaturas a las que operan, la pureza del combustible que utilizan, los rendimientos y las aplicaciones en las que pueden utilizarse.
Pilas de combustible de baja temperatura

En el caso de una pila de combustible de hidrógeno-oxígeno con un electrolito de hidróxido de metal alcalino, la reacción del ánodo es 2H2 + 4OH- ------- 4H2O + 4e- y la reacción del cátodo es O2 + 2H2O + 4e- ------- 4OH-.
Los electrones generados en el ánodo se mueven por un circuito externo que contiene la carga y pasan al cátodo. Los iones OH- generados en el cátodo son conducidos por el electrolito al ánodo, donde se combinan con el hidrógeno y forman agua. El voltaje de la pila de combustible en este caso es de unos 0,8 V pero disminuye conforme aumenta la carga. El agua producida en el ánodo debe ser extraída continuamente para evitar que inunde la pila.
Utilizan como combustible hidrógeno de gran pureza sin nada de monóxido o dióxido de carbono. La eficiencia ronda un 55%. Su principal ventaja es que operan a bajas temperaturas.

Las pilas de combustible de hidrógeno-oxígeno que utilizan membranas de intercambio iónico o electrólitos de ácido fosfórico fueron utilizadas en los programas espaciales Gemini y Apolo respectivamente. Las de ácido fosfórico tienen un uso limitado en las instalaciones eléctricas generadoras de energía.
Pilas de combustible que operan a alta temperatura
Actualmente se están desarrollando las pilas de combustible con electrólitos de carbonato fundido. El electrolito es sólido a temperatura ambiente, pero a la temperatura de operación (650 a 800 °C) es un líquido. Este sistema utiliza monóxido de carbono como combustible, por lo que pueden utilizarse como combustible mezclas de monóxido de carbono e hidrógeno como las que se producen en un gasificador de carbón.
También se están desarrollando pilas de combustible que emplean dióxido de circonio sólido como electrolito. Estas pilas se llaman pilas de combustible de óxido sólido. El dióxido de circonio se convierte en conductor iónico a unos 1.000 °C. Los combustibles más adecuados son el hidrógeno, el monóxido de carbono y el metano, y al cátodo se le suministra aire u oxígeno. La elevada temperatura de operación de las pilas de combustible de óxido sólido permite el uso directo de metano, un combustible que no requiere catalizadores costosos de platino.
Origen
Como muchas veces suele ocurrir, los principios científicos básicos que sustentan las pilas de combustible se descubrieron mucho antes de que se pudieran intuir sus aplicaciones.
En 1839, el jurista de profesión y físico de vocación Sir William Robert Grove (1811-1896), hizo público un experimento que demostraba la posibilidad de generar corriente eléctrica a partir de la reacción electroquímica entre hidrógeno y oxígeno. Su experimento consistía en unir en serie cuatro celdas electroquímicas, cada una de las cuales estaba compuesta por un electrodo con hidrógeno y otro con oxígeno, separados por un electrolito. Grove comprobó que la reacción del hidrógeno en el electrodo negativo combinada con la del oxígeno en el positivo generaba una corriente eléctrica que se podía usar a su vez para generar hidrógeno y oxígeno
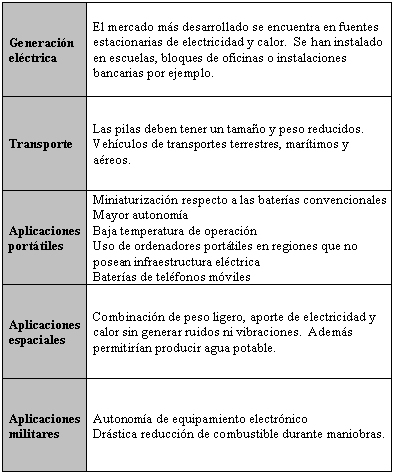
Algunas aplicaciones de las pilas de combustible
¿QUÉ HACEMOS EN EL ICMA?
En el ICMA; como Instituto de Materiales que somos, investigamos en materiales para pilas de combustible. En particular, estudiamos electrolitos y ánodos para las pilas de combustible de óxido sólido, y abordamos el procesado y el estudio de sus propiedades físicas (conductividad, estructura, microestructura, etc.).
Las condiciones a que están sometidos estos materiales en uso son severas (alta temperatura, ciclados térmicos, condiciones oxidantes y reductoras, etc.), por lo que existe campo para investigar en la búsqueda y optimización de los más idóneos. Serán aquellos que soporten mejor los ciclos y altas temperaturas o que, con mejores conductividades permitan reducir la temperatura de trabajo.
Disponemos de una instalación experimental para medir curvas I-V de las monoceldas que se fabrican. En la figura se ve el detalle de una celda convencional de circona con ánodo de NiO?circona y cátodo de LSM preparada para comprobar.
Los ánodos convencionales de estas celdas consisten en mezclas de óxido de níquel y circona preparadas por métodos cerámicos en los que la capa en contacto con el electrolito está especialmente tratada para que tenga una microestructura muy fina (Capa Funcional), y por ello muchos puntos de reacción para el combustible. En el ICMA estamos investigando métodos de modificación de esa Capa Funcional utilizando tratamientos de solidificación direccional por láser.
También investigamos métodos de sinterización localizada del electrolito sobre soporte metálico que permitan procesar pilas SOFC de temperatura intermedia (ITSOFC) soportadas en metal.
Si quieres obtener más información:
Nuevos materiales para pilas de combustible
Asociación Española de Pilas de Combustible (APPICE)
Tecnociencia: Especial Pilas de Combustible de Hidrógeno
www.tecnociencia.es/especiales/hidrogeno
Página de la asociación española del hidrógeno
Páginas con una descripción completa de pilas de combustible










